Gli scambi di energia e il principio zero della termodinamica
Gli scambi di energia e il principio zero della termodinamica rappresentano il fondamento su cui poggia l’interazione tra la materia e l’energia in fisica. Questi concetti, distillati nella loro essenza, sono tanto semplici quanto profondi nella loro applicazione pratica, poiché toccano ogni aspetto dell’esistenza fisica, dall’azione più banale al processo più complesso in natura.
Iniziamo col definire cosa si intenda per scambio di energia: è un processo che avviene costantemente intorno a noi. È la calore che sentiamo dal sole sulla pelle, l’elettricità che alimenta i nostri dispositivi, è la forza che muove un automobile: ogni volta che qualcosa cambia stato o posizione, energia è trasferita o trasformata in un altro tipo.
Il principio zero della termodinamica entra in gioco stabilendo una sorta di “regola del gioco” per questi scambi energetici. Esso afferma che se due sistemi termodinamici sono in equilibrio termico con un terzo sistema, allora sono in equilibrio termico anche tra loro. In termini meno formali, se due oggetti (per esempio una tazza di caffè e un cucchiaio) possono stare a contatto senza che uno dei due trasferisca calore all’altro, si dice che sono alla stessa temperatura.
Scopriamo insieme cosa significano questi due concetti e qual è la loro correlazione!
- Cos’è un sistema in termodinamica
- Lo stato di un sistema termodinamico
- La rappresentazione grafica dello stato di un sistema termodinamico
- Equilibrio termodinamico: cos'è
- Il principio zero della termodinamica
Cos’è un sistema in termodinamica
Un sistema in termodinamica è un corpo che possiamo immaginare avvolto da una superficie chiusa, ma permeabile alla materia e all’energia. L’ambiente è tutto ciò che si trova al di fuori di questa superficie. La termodinamica riguarda quindi qualsiasi aspetto della nostra vita.
Alcuni esempi di sistemi in termodinamica:
- Un aereo è un sistema costituito da numerosi pezzi (ali, fusoliera, motore ecc.). L’ambiente è invece tutto ciò che si trova al di fuori dell’aereo.
- Un gatto, la cui temperatura è di circa £$38.5 \ °C$£, emette calore e compie lavoro quando si muove. Mangiando e respirando riesce a reintegrare l’energia interna che perde.
- Da circa cinque miliardi di anni, il sole emette nello spazio energia sotto forma di radiazioni a spesa della propria energia interna, che diminuisce gradualmente.
La termodinamica studia le leggi con cui i sistemi scambiano energia con l’ambiente. Questi scambi di energia avvengono sotto forma di calore e di lavoro.
Quando un sistema riceve energia dall’esterno, la sua energia aumenta; quando la cede all’esterno, la sua energia interna diminuisce.
Lo stato di un sistema termodinamico
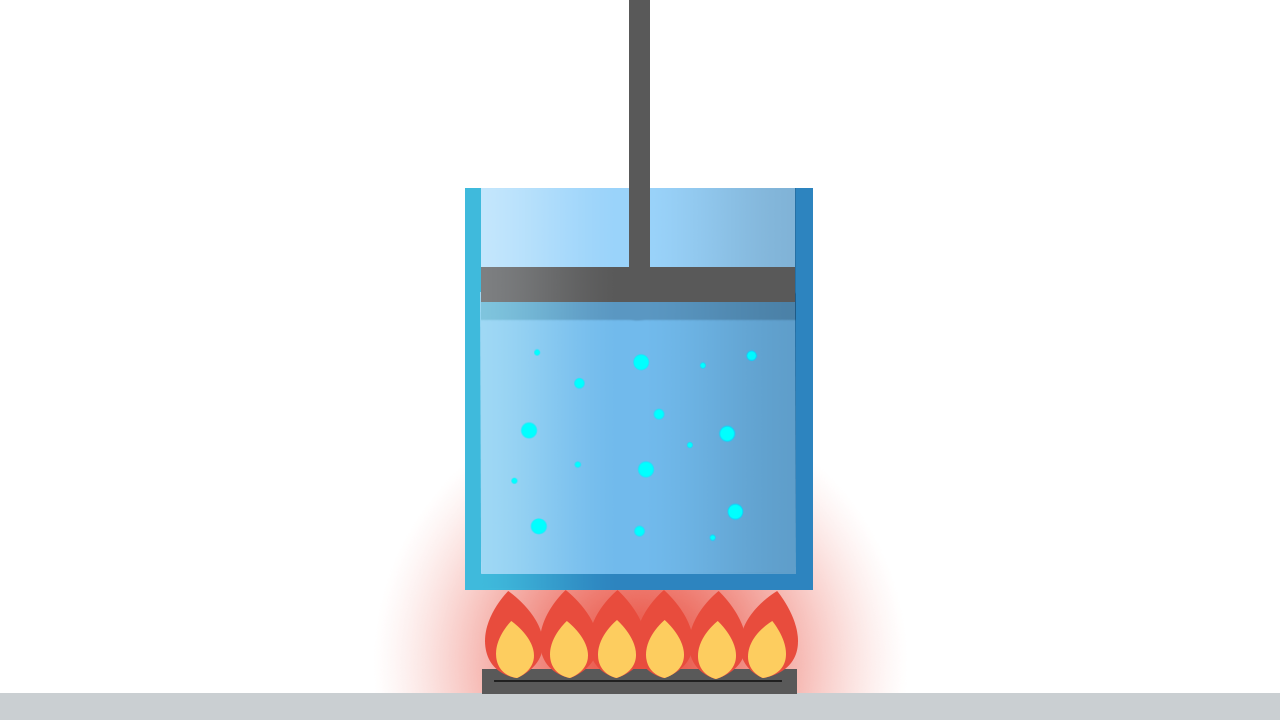
Per studiare gli scambi di energia, consideriamo un sistema termodinamico molto semplice: il gas perfetto contenuto in un cilindro sigillato da un pistone. L’ambiente è tutto ciò che è al di fuori di questo sistema: il fornello, quindi, fa parte dell’ambiente. Il sistema può scambiare lavoro e calore con l’ambiente.
Per esempio:
- con il fornello acceso, il sistema riceve energia dall’esterno sotto forma di calore;
- comprimendo il pistone, il sistema riceve energia sotto forma di lavoro compiuto da una forza esterna.
Ogni volta che riceve o cede energia, il sistema passa da uno stato ad un altro: per esempio, se si solleva il pistone, il volume occupato dal gas aumenta e la pressione può diminuire.
Lo stato del sistema ”n moli di gas perfetto” è descritto da tre grandezze:
- il volume £$V$£ del cilindro,
- la temperatura £$T$£ del gas e
- la pressione £$p$£ che il gas esercita contro le pareti.
Se misuriamo il valore di due di queste grandezze (per esempio £$p$£ e £$V$£), l’equazione di stato dei gas perfetti consente di ricavare la terza (£$T$£):
$$\boldsymbol{T=\frac{p\cdot V}{n\cdot R}}$$
La rappresentazione grafica dello stato di un sistema termodinamico
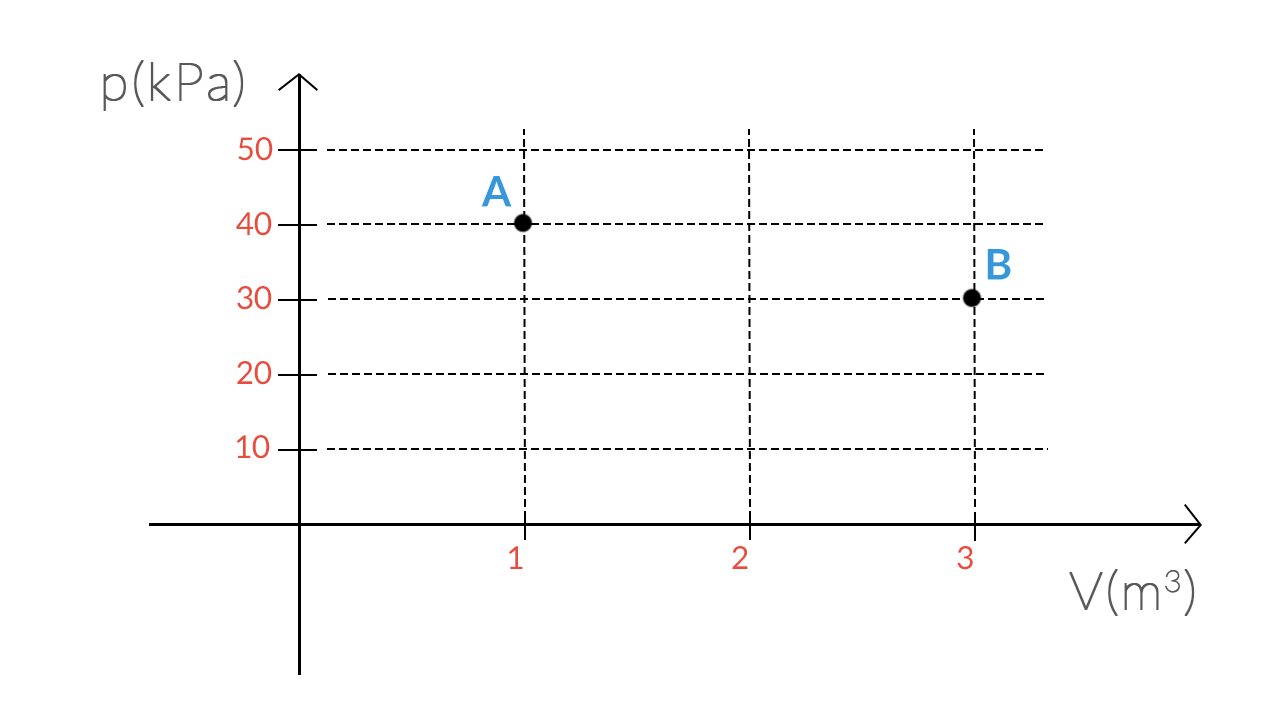
Lo stato di un sistema termodinamico può essere rappresentato con un punto in un grafico pressione-volume.
Per esempio: il sistema rappresentato dal punto A è individuato dalla coppia di valori £$(V=1.0\ m^3;p= 40\ kPa= 4 \cdot 10^4\ Pa)$£.
Sull’asse delle ascisse è rappresentato il volume, mentre sulle ordinate la pressione. A partire da questi elementi è sempre possibile risalire alla temperatura.
Rappresentare un grafico di questo tipo ci permette di capire facilmente come varia lo stato di un sistema.
Equilibrio termodinamico: cos’è
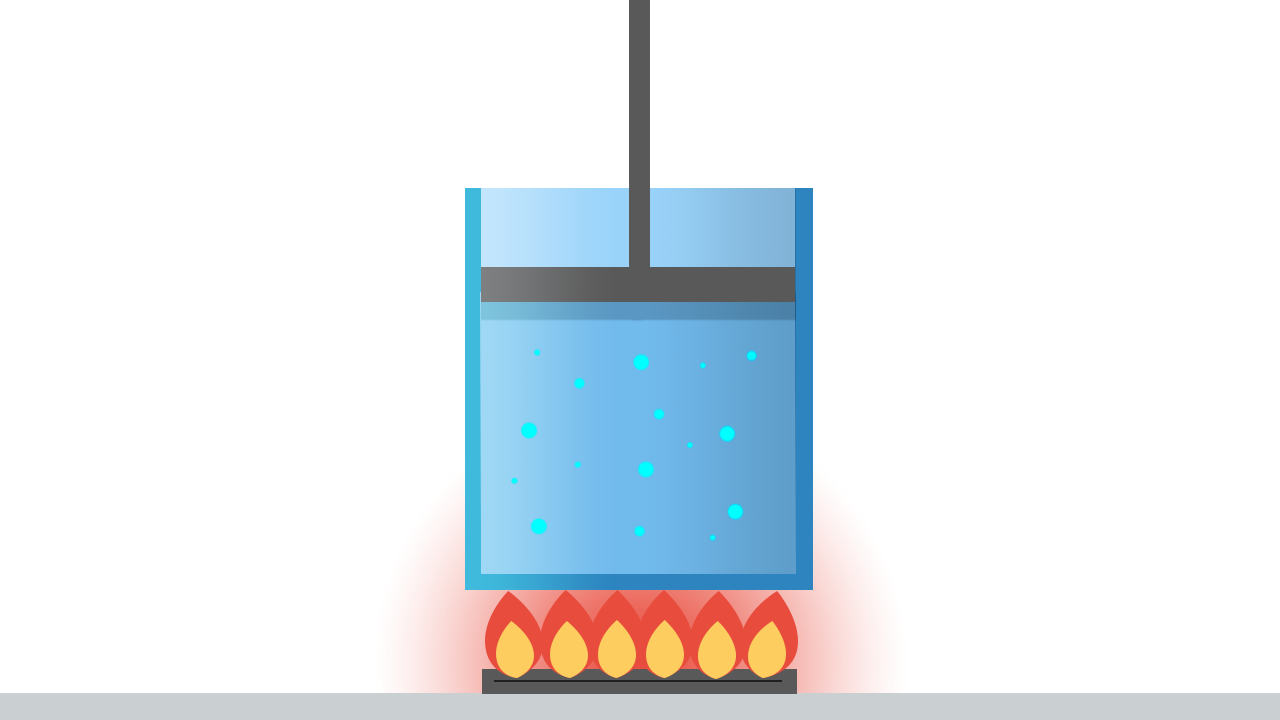
Torniamo a considerare il sistema termodinamico formato da un fluido omogeneo contenuto in un cilindro dotato di un pistone mobile a tenuta stagna.
Si può parlare di “pressione del sistema” o “temperatura del sistema” soltanto se queste grandezze sono le stesse in tutti i suoi punti.
Perchè questo si realizzi, il sistema in esame deve trovarsi nella condizione di equilibrio termodinamico, che richiede la presenza contemporanea di tre diversi tipi di equilibrio:
- Equilibrio meccanico: non devono essere presenti forze non equilibrate né all’interno del sistema, né tra il sistema e l’ambiente esterno. In particolare, per mantenere costante nel tempo il volume del sistema, la risultante delle forze che agiscono sul pistone deve essere nulla.
- Equilibrio termico: la temperatura deve essere uniforme in tutto il fluido.
- Equilibrio chimico: la struttura interna e la composizione chimica del sistema devono rimanere inalterate.
In seguito, faremo sempre l’ipotesi di lavorare con sistemi fisici che si trovano nella condizione di equilibrio termodinamico.
Il principio zero della termodinamica
Figura 1
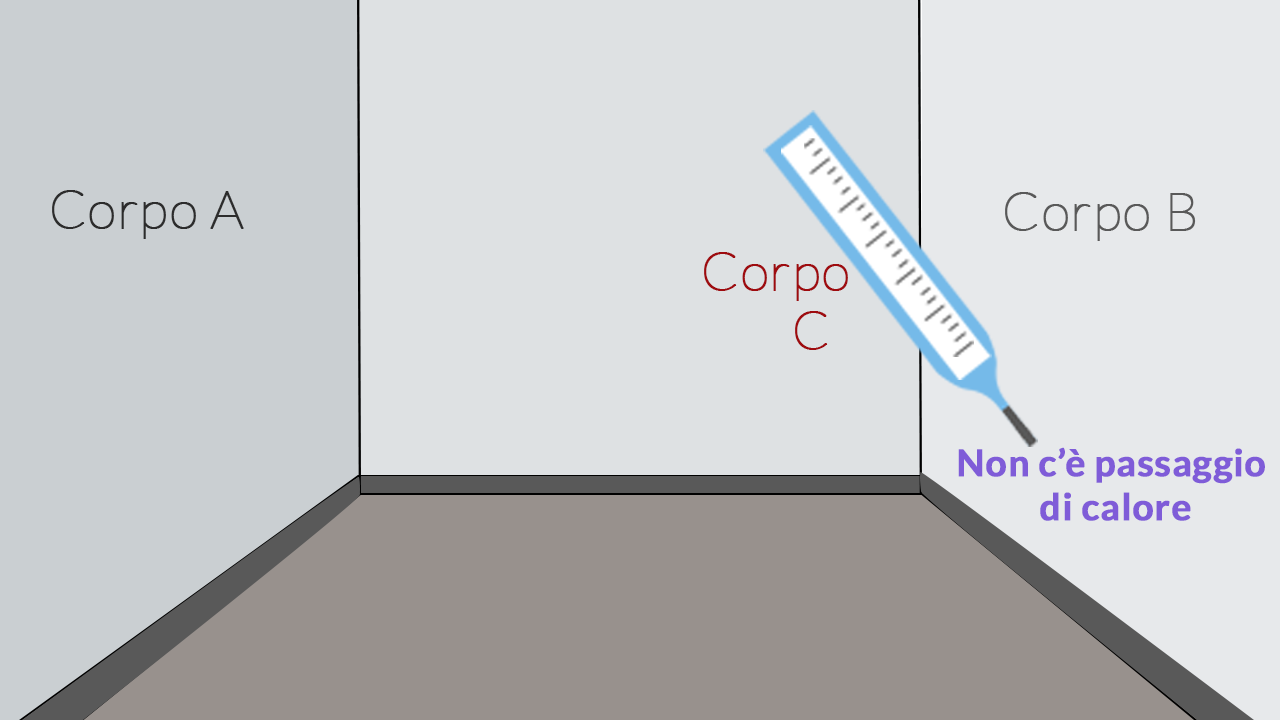
Figura 2
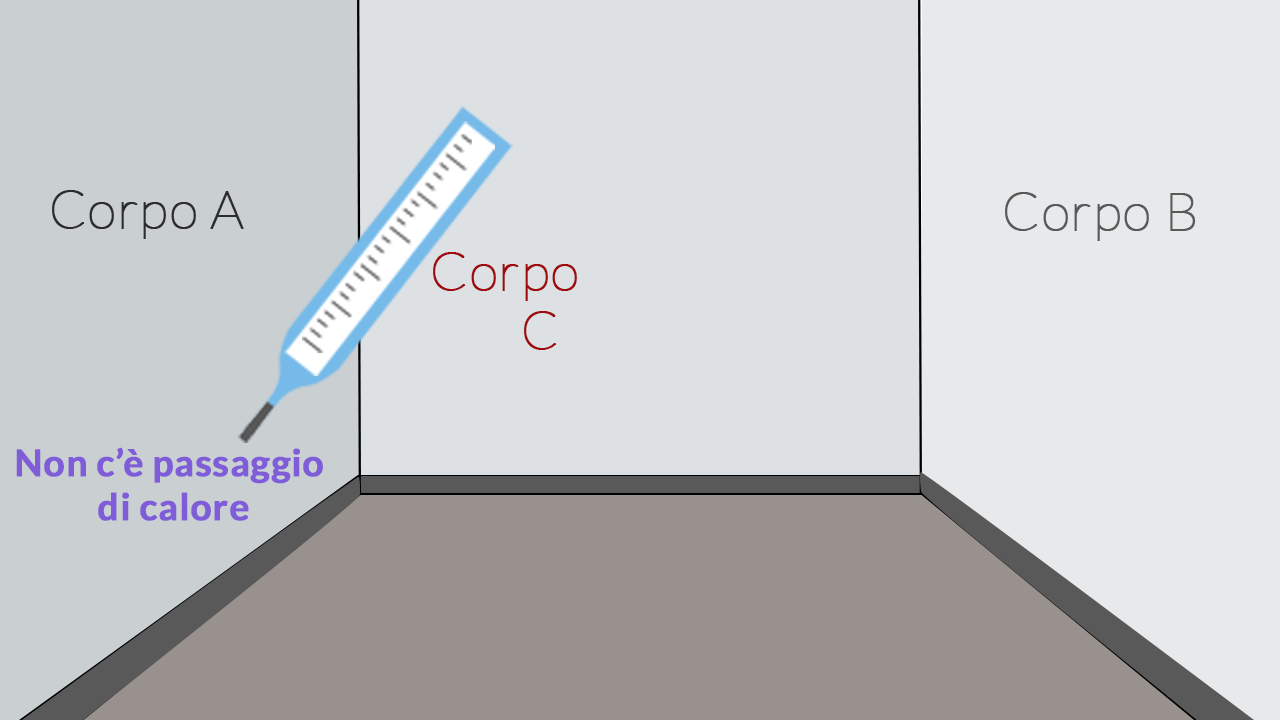
Per controllare se due corpi sono alla stessa temperatura dobbiamo porli a contatto. Se hanno la stessa temperatura £$T$£, essi non scambiano calore: sono in equilibrio termico.
Esempio:
Figura 1. Prendiamo in considerazione due pareti £$A$£ e £$B$£ di una stanza, prendiamo un termometro (corpo £$C$£) e lo mettiamo a contatto con la parete destra (corpo £$B$£) fino a quando essi non sono in equilibrio termico. Il termometro indica la propria temperatura, che è quella della parete sinistra.
Figura 2. Ora mettiamo in contatto lo stesso termometro (corpo £$C$£) con la parete di sinistra (corpo £$A$£). Se questi due corpi sono in equilibrio termico, la parete di destra ha la stessa temperatura del termometro, cioè la stessa della parete di sinistra.
Questo procedimento presuppone la validità di un criterio generale, necessario per confrontare le temperature di oggetti molto distanti tra loro nello spazio o nel tempo.
Questo criterio è detto principio zero della termodinamica: se un corpo £$A$£ è in equilibrio termodinamico con £$B$£ e un corpo £$B$£ è in equilibrio con £$C$£ allora £$A$£ è in equilibrio termodinamico con £$C$£.
ATTENZIONE!
Tale definizione non è differente da quella riportata ad inizio pagina ma rappresenta semplicemente un altro modo per enunciare il principio zero della termodinamica.
